
Sawa Józef
ZARZĄDZANIE ŚRODOWISKIEM I
EKOLOGIĄ
-2
ROLA
ENERGII W ŚRODOWISKU
Podstawowe żródła energii
Źródłem energii wykorzystywanej przez ludzi w ich działalności bytowej
i gospodarczej są kopaliny energetyczne, ale i szereg zjawisk
zachodzących w otoczeniu. Są to zjawiska takie jak: wiatr, przepływ wody
w ciekach, obieg wody w przyrodzie, absorpcja energii promieniowania
słonecznego, przypływy i odpływy morskie oraz prądy morskie. Źródłem
energii jest też energia geotermalna i energia wytwarzana w różnych
reakcjach jądrowych.
Woda oblewa ponad 2/3 powierzchni kuli ziemskiej i posiada szereg
specyficznych właściwości. Jedną z nich jest ta, że woda łatwo zmienia
swój stan skupienia w zależności od dostarczanej lub odbieranej jej
energii. W związku z tym obserwowane są zjawiska, w których uczestniczy
woda, takie jak przewodzenie ciepła, parowanie, kondensacja (skraplanie),
topnienie, krzepnięcie. Zjawiskom tym towarzyszą odpowiednie efekty
cieplne. Ciepło właściwe (cw) wody wynosi 1 cal/(g∙K), a ciepło
parowania (cp) 530 cal/g. Wartość ciepła właściwego wody wskazuje, że
aby ogrzać 1g wody od 0oC do 100oC (do temperatury jej wrzenia) trzeba
dostarczyć 100 cal ciepła. Wartość ciepła parowania oznacza, że
parowanie 1 g wody w temperaturze 100oC związane jest z pobieraniem
ciepła o wartości około 530 cal.
Podczas naświetlania słonecznego zbiorników wodnych jak i innych
elementów wilgotnych środowiska, woda odparowuje z różną prędkością
zależnie od jej temperatury (prężność pary wodnej). Jest to naturalny
proces ochładzania się zbiorników wodnych nagrzanych przez Słońce,
zachodzący często z różną intensywnością (rodzaj buforowania temperatury
naturalnych zbiorników wodnych). W analogiczny sposób organizmy żywe (zarówno
rośliny, jak i zwierzęta) bronią się przed przegrzaniem.
Zjawisko parowania wody ma istotny wpływ na lokalne (i nie
tylko) warunki atmosferyczne. Woda zamieniona w parę wodną migrując do
chłodnej atmosfery (w troposferze wyższe warstwy powietrza są coraz
chłodniejsze)niesie ze sobą określone ilości energii. Para wodna
kondensując w atmosferze oddaje energię parowania gazom zawartym w
atmosferze (530 cal na każdy gram pary wodnej). Ciężar właściwy
wilgotnego i ogrzanego powietrza ulega obniżeniu (para wodna posiada o
około 60% niższy ciężar właściwy od powietrza; ciężar właściwy pary
wodnej wynosi 0,804 kg/m3, a średni ciężar suchego powietrza 1,288
kg/m3), co wywołuje powstanie pionowych ruchów mas powietrza - prądów
wznoszących (ruch kominowy). Do powstania prądów wznoszących w powietrzu
przyczynia się również ukształtowanie terenu (góry, lasy itd.). Lokalnie,
w miejscach gdzie masy powietrza unoszą się następuje zmniejszenie jego
ciśnienia, a miejscach gdzie powietrze opada – wzrost ciśnienia. Zmiany
ciśnienia powietrza powodują jego przepływ w kierunku od miejsc o
wyższym ciśnieniu do miejsc o ciśnieniu niższym. Te miejscowe zjawiska
polegające na poziomym ruchu powietrza atmosferycznego określa się
mianem wiatru. Nad dużymi zbiornikami wodnymi (w strefach oceanicznych)
ruchy poziome atmosfery przybierają na sile – nazywane są huraganami czy
trąbami powietrznymi).
Łagodniejsze zachodzenie zjawiska migracji wody pomiędzy
atmosferą a powierzchnią ziemi pozwala na utrzymywanie wilgotności gleb
oraz stabilizacji temperatury w zbiornikach wodnych. Sprzyja to również
transportowi obłoków pary wodnej z nad oceanów i mórz nad obszary lądowe,
dzięki temu nad lądami występują opady deszczu. Stabilizacja
temperaturowa w zbiornikach wodnych pozwala na bytowanie w nich
organizmów żywych. Problem ten jest o tyle istotny, że zachodzi zmiana (zmniejszanie
się) rozpuszczalności tlenu w wodzie ze wzrostem temperatury. Z kolei
tlen w wodzie niezbędny jest do życia organizmów wodnych.
TECHNIKI I TECHNOLOGIE
UZYSKIWANIA I STOSOWANIA ENERGII
Energia paliw kopalnych
Tradycyjny sposób pozyskiwania energii na cele działalności ludzi polega
na chemicznym spalaniu wszelkiego rodzaju surowców energetycznych:
stałych, ciekłych i gazowych. Sposób ten stosowany jest od tysięcy lat.
Głównymi palnymi składnikami paliw kopalnych (torf, różne rodzaje węgla,
lupki bitumiczne, ropa naftowa, gaz ziemny) są węgiel, węglowodory i ich
pochodne. Natomiast przeważającym składnikiem paliw typu biomasa
roślinna (siano, słoma, liście, chrust, drewno) są węglowodany.
Najprostszym sposobem uzysku energii z tych paliw było i nadal jest
spalanie ich w powietrzu. Tlen obecny w powietrzu w ilości 21% obj. Jest
głównym utleniaczem.
Rozwój techniki i technologii spowodował wzrost zapotrzebowania na
paliwa o określonych właściwościach, specyficznych dla poszczególnych
procesów technologicznych. Z racji tego naturalne surowce energetyczne(paliwa
kopalne) są przerabiane na potrzebne paliwa, takie jak koks, nafta,
benzyna, rozpuszczalniki itp.
Usuwanie z naturalnych paliw zbędnych, a często szkodliwych
składników z różnych przyczyn (m.in. ekonomicznych, konieczności
stosowania skomplikowanych technik oczyszczania, brak stosownej techniki
oczyszczania)nie jest prowadzone lub jest wykorzystywane tylko częściowo.
Wobec tego w procesie spalania naturalnych paliw biorą udział również
zawarte w nich zanieczyszczenia, a produkty przemian chemicznych tych
zanieczyszczeń przechodzą do spalin. Przykładem zbędnej substancji
zawartej w paliwie (węgiel) jest siarka.
Reakcje spalania węgla (głównego składnika paliw) można zapisać
równaniami:
C+O2→CO2+Q Q=97 kcal/mol
2
C+O2→CO+Q Q=29,3 kcal/mol
Reakcje te mogą przebiegać równocześnie, co głównie zależy od
warunków, w jakich one przebiegają (dostępności utleniacza: powietrza).
Od warunków prowadzenia procesu spalania paliw uzależnione jest
powstawanie określonych jego produktów. Dla przykładu przy realizacji
procesu spalania z niedoborem utleniacza powstają tzw. niedopały (gazowe,
m.in. CO i węglowodory, stałe – węgiel w popiele). Prowadzenie spalania
paliw w powietrzu atmosferycznym w temperaturze powyżej 10000C powoduje
powstawanie mieszaniny tlenków azotu (NOx).
Do zrozumienia procesów spalania paliw niezbędna jest wiedza o
paliwach i warunkach przebiegu tych procesów. Paliwa posiadają
różnorodną strukturę: gazową, ciekłą, stałą o różnej porowatości i
stopniu rozdrobnienia. Zgodnie z prawem działania mas pierwiastki czy
związki chemiczne reagują ze sobą proporcjonalnie do mas atomowych czy
cząsteczkowych. Masa cząsteczkowa jest sumą mas atomowych wszystkich
atomów tworzących cząsteczkę pierwiastka lub związku chemicznego. Masa
jednego mola substancji chemicznej jest liczbowo równa jego masie
cząsteczkowej. Wartość masy jednego mola substancji (pierwiastka lub
związku chemicznego) wynosi od kilku do kilkuset gramów w zależności od
składu chemicznego danej substancji. Mol każdej substancji zamienionej
na parę lub występującej w formie gazowej przyjmuje objętość 22,4 dm3w
warunkach ciśnienia normalnego i temperatury normalnej.
Z reakcji utleniania (spalania) węgla wynika, że aby spalić w
warunkach normalnych 12g węgla (C) potrzeba 22,4 dm3 tlenu, a powietrza
ponad sześć razy więcej (około 140 dm3 przy założeniu, że spalanie
odbywa się przy 30% nadmiarze powietrza). Z uwagi na fakt, że węgle
naturalne(paliwo) są ciałem stałym i mieszaninami różnorodnych
pochodnych węgla proces jego spalania będzie przebiegał dość
skomplikowanie. Jeżeli paliwo jest gazowe, np. metan(CH4), który
stosunkowo dobrze miesza się z powietrzem, spalanie jest proste. Może
być jednak niebezpieczne (po zmieszaniu w odpowiednim stosunku metanu z
powietrzem powstaje mieszanina wybuchowa). Reakcję spalania metanu
wyraża równanie:
CH4+ 2 O2 → CO2+ 2
H2O+Q
Metan jest głównym składnikiem gazu ziemnego, który poza
węglem należy do ważnych kopalnych surowców energetycznych.
Paliwem użytkowym jest ponadto mieszanina gazów uzyskiwana w
procesie zgazowania węgla. Proces ten bywa stosowany w podziemnych
pokładach węgla, a także w urządzeniach naziemnych. Proces zgazowania
węgla prowadzi się przez częściowe utlenianie (spalanie) węgla przy
udziale powietrza bądź powietrza wzbogaconego parą wodną w temperaturze
powyżej 600oC.
Efektem końcowym przemian w procesie spalania paliw naturalnych
jest energia, spaliny i pozostałość stała (odpady stałe). Spaliny, po
odebraniu od nich energii stają się produktem ubocznym procesu spalania.
Są one znacznie zanieczyszczone. Zanieczyszczenia w spalinach zależą od
przebiegu procesu spalania i właściwości stosowanego paliwa, na które z
kolei wpływ mają zawarte w paliwach różne składniki palne i niepalne.
Podczas dynamicznego procesu spalania rozdrobnione składniki stałe
paliwa porywane są przez spaliny. Składniki te nazywane są
zanieczyszczeniami pyłowymi spalin. Struktura mieszanin palnych i
dynamika procesu spalania uniemożliwia osiąganie stanu równowagi
chemicznej, co skutkuje wytwarzaniem całego szeregu zanieczyszczeń
spalin zarówno pyłowych, jak i gazowych. Przykładowo są nimi dwutlenek
siarki (SO2), tlenki azotu (NOx), sadza, niedopały.
Paliwa ciekłe, a często niektóre stałe podgrzewa się w celu
poprawienia ich spalania (uzyskania temperatury zapłonu). Kostki
parafiny nie da się zapalić wprost od płomienia zapalniczki, natomiast
świecę od knota zapala się bez trudu. Aby usprawnić niektóre procesy
przemysłowe paliwo stałe (węgiel) rozdrabnia się do struktury pyłowej,
następnie spala się go w strumieniu powietrza. Z kolei paliwa ciekłe w
silnikach samochodowych rozpyla się do aerozoli przed ich spalaniem.
Brak możliwości magazynowania spalin, konieczność odprowadzania ich
do atmosfery oraz zawarty w spalinach dwutlenek węgla (CO2) - główny
produkt spalania paliw zawierających pierwiastek węgiel - powodują
znaczne zakłócenia w lokalnym otoczeniu.
Surowcem energetycznym, którego spalanie nie powoduje powstawania
dwutlenku węgla jest gazowy wodór (H2). Spalanie wodoru przedstawia
równanie:
2 H2+O2→2 H2O+Q
Przy stosowaniu tego paliwa wzrasta zagrożenie wybuchem, co wynika
z tego, że wodór ma duże powinowactwo do tlenu. Występują również
trudności związane z zapewnieniem szczelności zbiorników magazynowych.
Jest to gaz o najmniejszej cząsteczce, musi być magazynowany pod
zwiększonym ciśnieniem. Gaz ten potrafi przenikać przez strukturę
metalową. W praktyce przemysłowej do czyszczenia wodoru wykorzystywane
są króćce palladowe.
Wodór w stanie wolnym nie występuje w przyrodzie. W naturze zawsze
jest związany z innymi pierwiastkami. Praktycznie otrzymywany jest przez
rozkład jego związków (H2O, CH4 -metan, węglowodory). Czysty wodór
uzyskuje się w procesie elektrolitycznego rozkładu wody. Jest to sposób
bardzo energochłonny, co wpływa na cenę wodoru. W miarę ekonomicznie
uzyskuje się wodór przez termiczny rozkład wody za pomocą paliw
węglopochodnych, najkorzystniej za pomocą metanu (metan jest również
źródłem wodoru). W procesach otrzymywania wodoru powstają mieszaniny
gazów ze znaczną zawartością wodoru oraz równocześnie proporcjonalnymi
zawartościami dwutlenku węgla i innych składników gazowych.
Zużycie rozważanych surowców energetycznych na wytworzenie 1
MWh energii elektrycznej zestawiono w tabeli 1.
Tabela 1. Zużycie surowców energetycznych na wytworzenie 1 MWh
energii elektrycznej
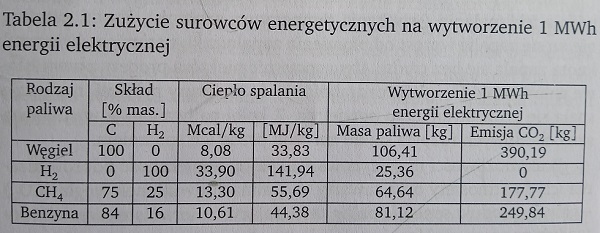
Do uzyskania około 25 kg H2 (25,36 kg według tab.1) w procesie
elektrolizy wody potrzeba około 1,43 MWh energii, przy założeniu
sprawności procesu na poziomie 70%. Rozpatrując produkcję H2 z innych
niż woda źródeł (np. CH4) należy uwzględnić dodatkowo stratę energii na
uzyskanie gazowego wodoru i jego oczyszczenie na poziomie 10-20%. W
efekcie końcowym zastosowanie wodoru jako paliwa gazowego pozwala na
odzyskanie 40-50% energii stosowanej do produkcji czystego gazowego
wodoru.
W wyniku spalania paliw uzyskuje się energię głównie cieplną w
ilości zależnej od ich składu i wartości opałowej. Z przedstawionych w
tabeli 1 wartości opałowych paliw wynika, że najbardziej energetycznym
paliwem jest wodór. Szeroko jest stosowany, jako surowiec w przemyśle
chemicznym.
Rozwój cywilizacji pobudza olbrzymi wzrost zapotrzebowania na
energię niezbędną do wdrażania nowych, coraz bardziej skomplikowanych
technologii, a również w wielu przypadkach na zbędne produkty i usługi.
Zapotrzebowanie na energię jest bardzo różne w poszczególnych
społeczeństwach, np. w przeliczeniu na mieszkańca w USA wynosi około 325
GJ/rok, a w Afryce około 13 GJ/rok. Spalanie paliw jest aktualnie
głównym źródłem energii, a równocześnie źródłem emisji zanieczyszczeń,
która ma istotny wpływ na systematyczne naruszanie równowagi
przyrodniczej w obrębie kuli ziemskiej. Coraz częściej dostrzeganym
efektem naruszenia tej równowagi jest występowanie anomalii
przyrodniczo–klimatycznych. Obecnie istotnym problemem jest brak
skutecznego sposobu, ekonomicznie uzasadnionego w powszechnym
zastosowaniu, magazynowania energii chwilowo zbędnej (nadprodukowanej),
często bardzo potrzebnej w godzinach szczytu zapotrzebowania.
Populacja ludzka przez ostatnie 100-lecie wzrosła blisko
pięciokrotnie. Intensywny rozwój przemysłu i rolnictwa pozostawia
olbrzymi ślad w środowisku globalnym. Uwolnione do atmosfery gazy z
zakładów przemysłowych i pojazdów mechanicznych, odpadowe ciepło, ścieki,
odpady ciekłe i stałe zrzucane do wód lub składowane na lądzie są tego
przyczyną. Są to skutki niezamierzone lub rozmyślne prowadzonej
działalności powodujące zanieczyszczenia atmosfery, wody, czy lądów wraz
z glebą. W efekcie końcowym wpływają, często negatywnie, na jakość życia
wszystkich organizmów.
Tekst, tabele i szkice - dr Józef
Sawa i dr Halina Marczak
Korekta: mgr Krystyna Sawa


